307: βラクタマーゼの活動をとらえる(Capturing Beta-Lactamase in Action)
現在使われている抗生物質の約75%はβ-ラクタム系(beta-lactams)であり、ペニシリン系(penicillins)、セファロスポリン系(cephalosporins)、カルバペネム系(carbapenems)も含むこれらの抗生物質はいずれも特徴的な4員環ラクタム環を有している。これらの抗生物質が有効なのは、細菌の細胞壁を再構築するタンパク質の天然基質に似ているからである。細胞壁の酵素がβ-ラクタム系の薬剤と結合すると、通常の基質との結合が阻害され、細胞壁の形成が停止して、最終的に細胞死に至る。しかし、細菌はβ-ラクタマーゼ(beta-lactamase)と呼ばれるタンパク質群を使って耐性を発達させてきた。β-ラクタマーゼは、β-ラクタム系分子に結合してラクタム環を切断し、抗生物質を効かなくすることで機能する。
新たな技術により原子スケールで反応の詳細を可視化できるようになった
より優れた薬剤を設計するには、β-ラクタマーゼがどのように作用するかを理解することが不可欠である。しかし、切断反応は非常に速く起こるため、標準的な構造解析技術でとらえるのは難しい。X線結晶構造解析では、結晶化したタンパク質にX線を照射して回折パターンをとらえ、これを用いて分子構造を決定する。これらのX線は連続的で比較的強度が弱いため、結晶を長時間X線に曝しながらデータを収集することができる。新しい技術である連続フェムト秒結晶構造解析法(serial femtosecond crystallography、SFX)では、X線自由電子レーザー(X-ray free-electron laser、XFEL)を利用し、試料に強いX線パルスを短時間照射し、試料が破壊される直前に回折パターンをとらえる。
SFXでは小さな結晶を使うことができ、特別に設計された拡散ミキサー内で、抗生物質などの小さな化学物質をタンパク質の結晶へと素早く導入することができる。これらの低分子はタンパク質結晶中に拡散し、反応を引き起こす。二液混合連続結晶構造解析法(mix and inject serial crystallography、MISC)と呼ばれるこの新しい方法では、混合後の異なるタイミングでXFELビームに注入することにより、反応を高分解能で観察することができる。
抗生物質に抵抗する活動
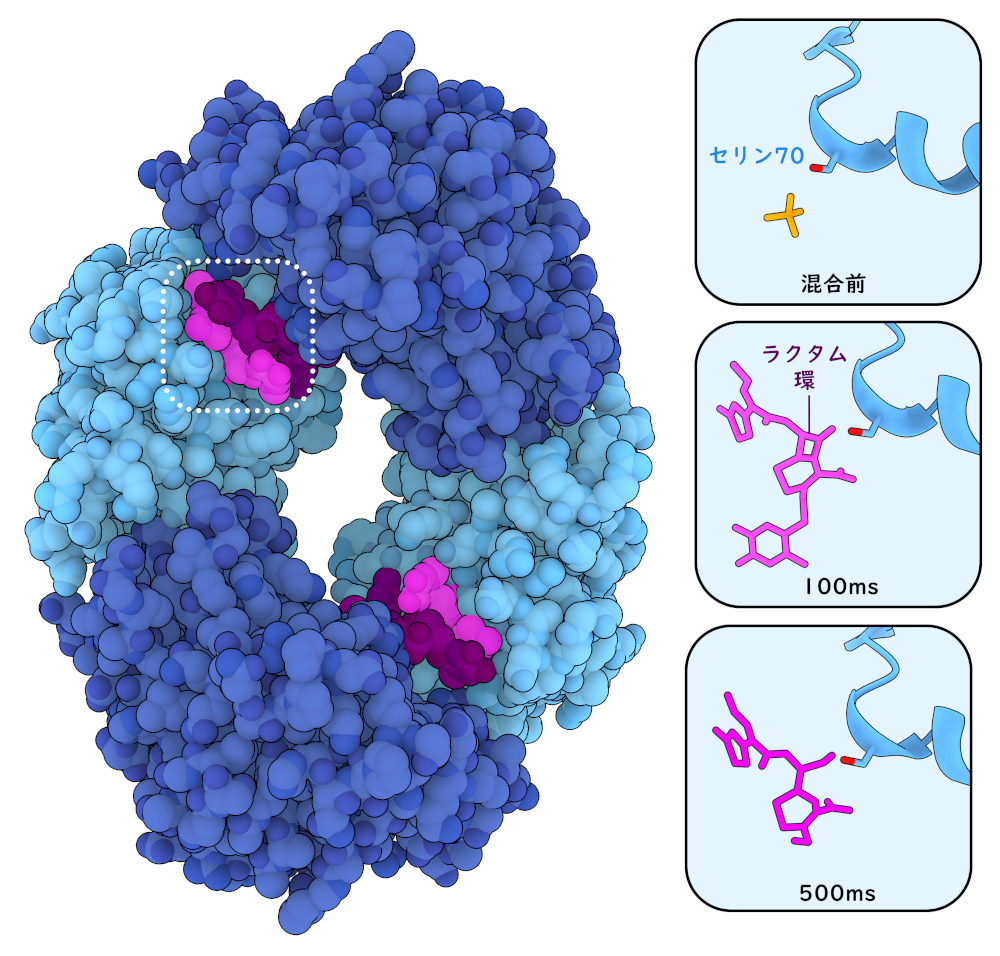
2018年、XFEL光源でβ-ラクタマーゼの作用をとらえられるかどうかを調べるためにMISC実験が計画された。この実験では、結核菌(Mycobacterium tuberculosis)が持つβ-ラクタマーゼBlaCの小さなタンパク質結晶を、X線パルスを照射する直前に抗生物質セフトリアキソン(ceftriaxone)と混合した。混合後30ミリ秒、100ミリ秒、500ミリ秒、2秒のデータを収集した結果、切断反応は主に100ミリ秒から500ミリ秒の間に起こることがわかった。この反応は、β-ラクタム環を開き、共有結合した中間体を形成してからβ-ラクタムを加水分解して遊離するという反応であり、β-ラクタマーゼのセリンによる求核攻撃が関与している。そして酵素は、2秒以内にはもう次の新しい抗生物質と結合している。右図に示すように、BlaCは同じ酵素4分子からなる4量体(6B68)として結晶化する。だが興味深いことに、実験中に切断反応を触媒したのは、4つの酵素のうち2つだけであった。
阻害剤の作用をとらえる
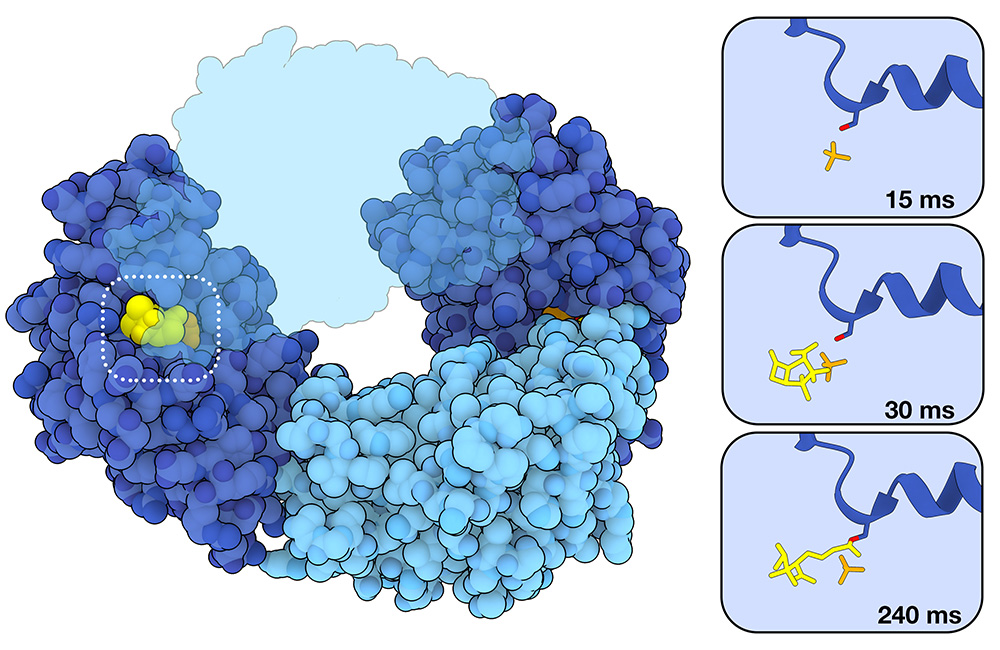
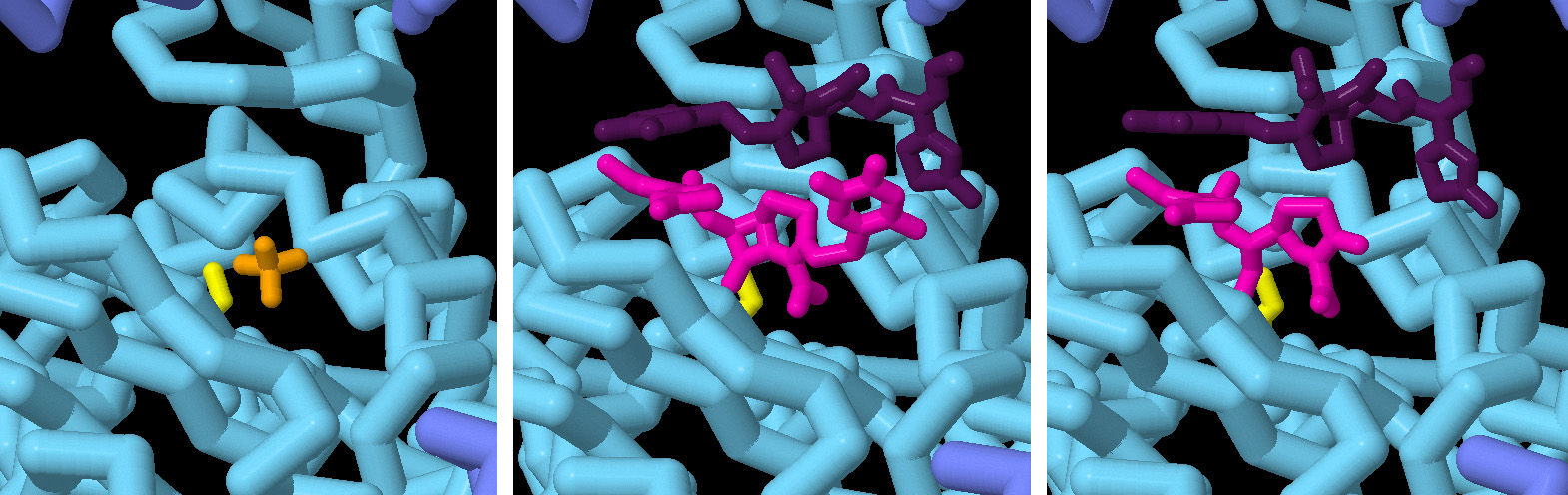
二液混合連続結晶構造解析法は、β-ラクタマーゼに不可逆的に結合してその活性を阻害する、いわゆる自殺基質阻害剤によるβ-ラクタマーゼ阻害の研究にも用いられている。スルバクタム(sulbactam)と呼ばれるこのような薬剤によるBlaCの阻害に関する研究が最近行われた。左図に示すように、阻害の過程は、活性部位において非共有結合性の酵素-阻害剤複合体がつくられることから始まる(30 ms, 8EBR)。セフトリアキソンとの反応と同様に、触媒活性を持つセリンによる求核攻撃がこれに続く。しかしこの場合、共有結合したアシル-酵素中間体が生じ、酵素は不活性化される(240 ms, 8EC4)。セフトリアキソンのような抗生物質よりもサイズが小さいスルバクタムは、4つのBlaCサブユニットすべての活性部位で観察された。しかし、水色で示す2つのサブユニットでは、反応が非常に速く起こるため、あらかじめ触媒されたスルバクタム基質は観察されなかった。一方濃い青色で示すサブユニットの場合、反応はゆっくりと進行し触媒反応前にスルバクタム基質が結合するのが観察できた。スルバクタムおよび類似の阻害剤は、米国食品医薬品局(FDA)により、すでに承認されているβ-ラクタム系抗生物質との配合剤(例えば、スルバクタムとアンピシリン ampicillin を配合した、ウナシン Unasyn など)での使用が承認されている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
この一連のスナップショットでは、抗生物質(セフトリアキソン)の結合とそれに続くβ-ラクタム環の切断を原子分解能で示しいる。酵素の触媒セリンは黄色で示す。ピンク色で示すのは不活性化された抗生物質、紫色で示すのは活性部位が空になってから結合する2番目の抗生物質分子である。図の下のボタンをクリックして対話的操作のできる画像に切り替え、構造の動画を見てみて欲しい。
理解を深めるためのトピックス
- 別のβ-ラクタマーゼであるニューデリー メタロβラクタマーゼ(new delhi metallo-β-lactamase)についても学んでみよう。
- 詳しくは耐性菌と抗生物質耐性について(superbugs and antibiotic resistance)を読んでみて欲しい。
- 抗生物質の種類によって微生物を攻撃する方法は異なる。細菌を攻撃する抗生物質の多くは、ペニシリン(penicillin)やバンコマイシン(vancomycin)のように細胞壁を攻撃する。しかし、アクチノマイシン(actinomycin)のようにDNAを標的とする抗真菌剤もある。
- 時間分割結晶構造解析法(time-resolved crystallography)は、光活動性黄色タンパク質(photoactive yellow protein)のような光で活性化されるタンパク質の捕捉にも使われている。
参考文献
- 6B5X, 6B68, 6B69 2018 Enzyme intermediates captured “on the fly” by mix-and-inject serial crystallography. BMC Biol 16 59
- 8EBI, 8EBR, 8EC4 2023 Heterogeneity in M. tuberculosis β-lactamase inhibition by Sulbactam. Nat Commun 14 5507
- 2016 Aug 29 Mixing injector enables time-resolved crystallography with high hit rate at X-ray free electron lasers. Struct Dyn. ;3 ;5 054301
- 2018 Megahertz serial crystallography. Nat Commun 9 4025
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト